Als de veiligheid en/of prestaties van een medisch hulpmiddel (instrument, toestel, software, reagens, materiaal,…) worden beoordeeld aan de hand van gegevens die afkomstig zijn van deelnemers aan het onderzoek, is het onderzoek een klinisch onderzoek volgens de definitie van de MDR.
Op 26 mei 2021 is de Europese Verordening (EU) 2017/745 betreffende medische hulpmiddelen (MDR) in werking getreden. De MDR introduceert een belangrijke update van het regelgevingskader in de Europese Unie en brengt verschillende wijzigingen met zich mee voor de omvang van de klinische studies die ter goedkeuring moeten worden ingediend, de initiële indieningsprocessen en de substantiële wijzigingen daarvan, de inhoud van het indieningsdossier en de veiligheidsrapportage.
Zoals uit de onderstaande beslisboom blijkt, moet het onderzoek worden voorgelegd aan de juiste regelgevingsroute, afhankelijk van het type medisch hulpmiddel dat in het onderzoek wordt gebruikt en het type onderzoek.
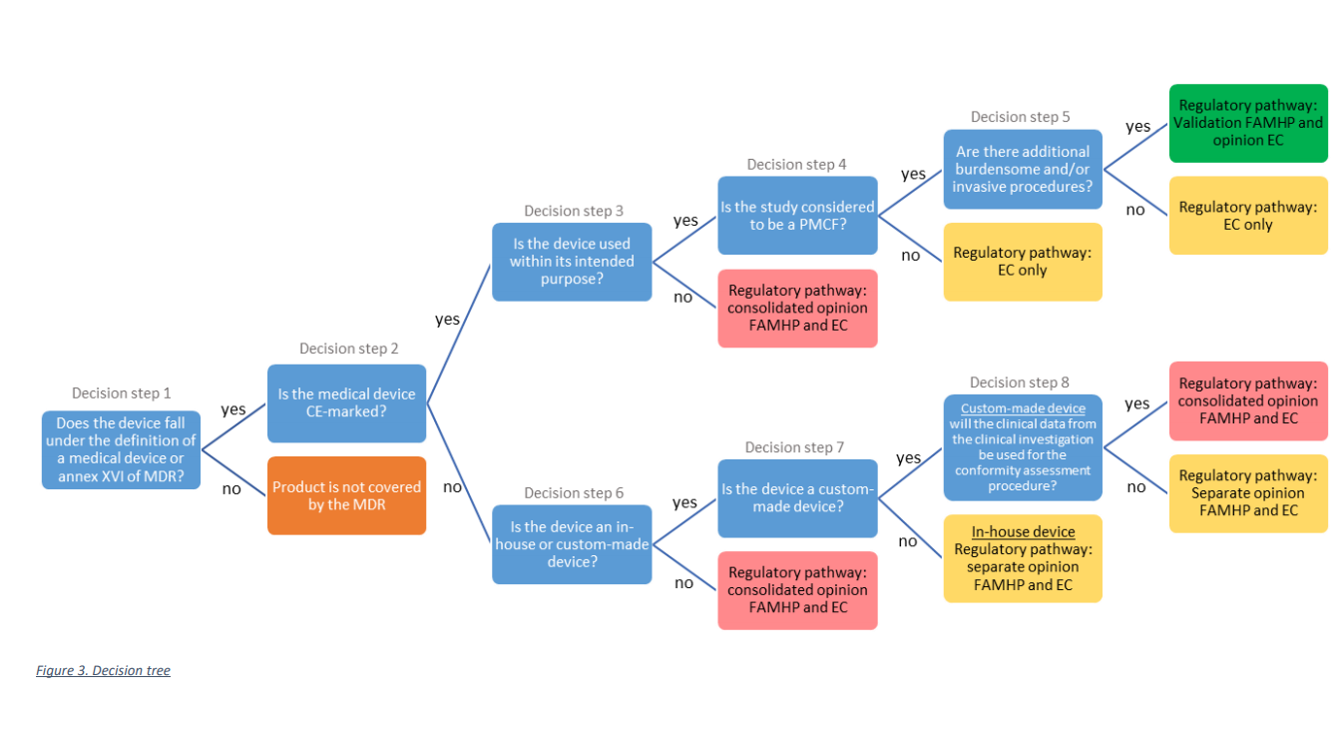
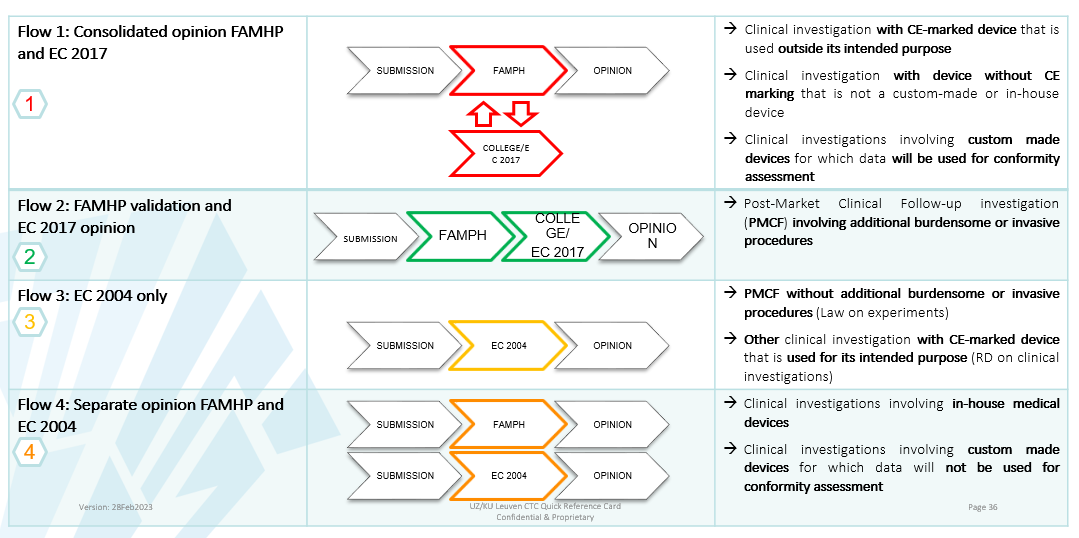
Verschillende flows onder MDR
Verschillende flows onder MDR
- Meer nuttige informatie over klinisch onderzoek is beschikbaar op de webpagina van het FAGG:
-
Elk instrument, apparaat, toestel, software, implantaat, reagens, materiaal of ander artikel kan een medisch hulpmiddel zijn. Een app kan dus ook een medisch hulpmiddel zijn. De uitgebreide definitie van medisch hulpmiddel staat in artikel 2 van de MDR.
De bepaling of iets een medisch hulpmiddel is, is gebaseerd op het beoogde (medische) doel. Het beoogde doel beschrijft waarvoor het product is ontworpen.Op deze website kunt u een quick scan doen om te bepalen of een hulpmiddel of software als medisch hulpmiddel moet worden aangemerkt: https://cetool.nl/en/medical-device