Een prestatiestudie is een studie met een in vitro diagnostic medical device (IVD) die wordt uitgevoerd ter bepaling of bevestiging van de analytische of klinische prestaties van een hulpmiddel. Met analytische prestaties wordt het vermogen bedoeld van een IVD om een specifiek analyt correct te detecteren of te meten. Met klinische prestatie wordt het vermogen bedoeld om resultaten te leveren die klinisch relevant zijn.
Vanaf 26 mei 2022 trad de Europese Verordening (EU) 2017/746 inzake in vitro medische hulpmiddelen (IVDR) in werking. De IVDR introduceert een belangrijke update van het regelgevingskader in de Europese Unie en brengt verschillende wijzigingen met zich mee in de reikwijdte van prestatiestudie die ter goedkeuring/notificatie moeten worden ingediend, de initiële indieningsprocessen en hun substantiële wijzigingen, de inhoud van het indieningsdossier en de veiligheidsrapportering.
Zoals uit de onderstaande beslisboom blijkt, moet het onderzoek worden voorgelegd aan de juiste regelgevingsroute, afhankelijk van het type prestatiestudie.
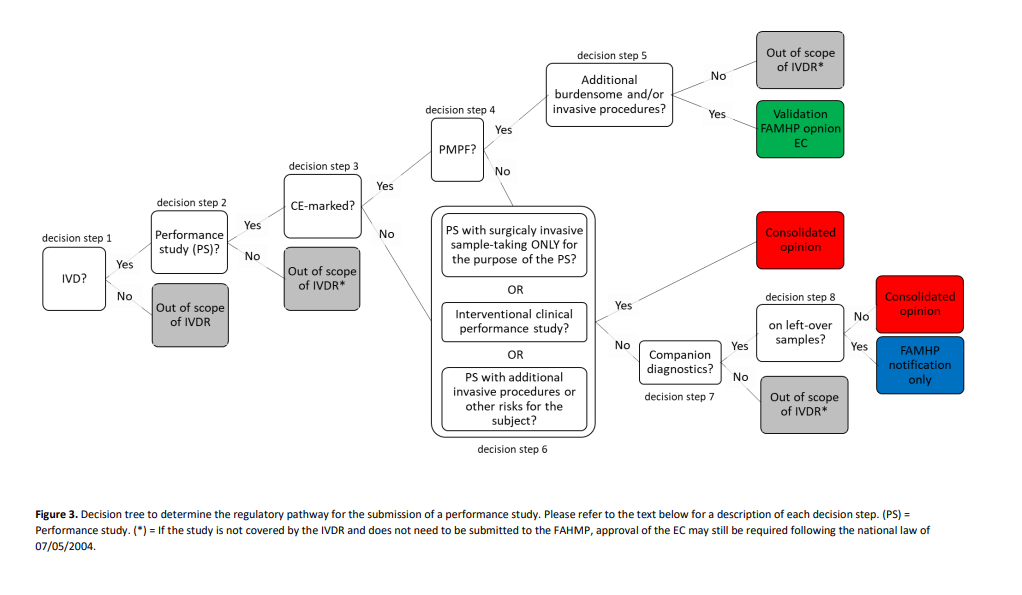
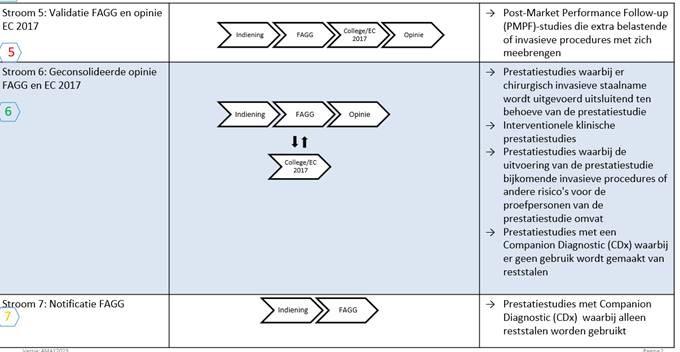
Meer nuttige informatie over onderzoek in het kader van de IVDR is beschikbaar op de webpagina van het FAGG: https://www.fagg-afmps.be/nl/MENSELIJK_gebruik/gezondheidsproducten/medische_hulpmiddelen_hulpstukken/klinische_evaluatie/inhoud_aangiftedossier