De klinische presentatie van een verworven laryngotracheale stenose wordt bepaald door symptomen van inspanningsdyspnee, stridor en een gevoel van vastzittende secreties. Ook stemverandering wordt gerapporteerd in zeldzamere gevallen.
De meest voorkomende luchtwegstenose op laryngeaal niveau is een geïsoleerde posterieure glottis stenose (PGS), dewelke voorkomt als een vernauwing van de interaytenoïdale glottis t.g.v. fixatie van 1 of beide stembanden. Dit is meestal het resultaat van langere periodes van endotracheale intubatie waarbij druknecrose van de endotracheale tube ter hoogte van de interarytenoïdale mucosa uiteindelijk kan leiden tot stenosevorming met fixatie van de arytenoïden. Verschillende graden van stenose kunnen gedefinieerd worden: Type I (interarytenoïdale adhesie), Type II (PGS met bewaarde mobiliteit van beide arytenoïden), Type III en IV (PGS met éénzijdige of bilaterale crico-arytenoid ankylose en dewelke meestal geassocieerd zijn met ernstige interarytenoïdale littekenvorming).
Een verworven bilaterale stembandparalyse is een andere, minder voorkomende oorzaak van een kritische luchtwegstenose op laryngeaal niveau. Hierbij wordt het luchtweglumen beperkt door een stilstand van beide stembanden in paramediane positie ten gevolge van onderliggende neurogene problematiek, meest frequent iatrogeen (bv. bilaterale n. recurrensbeschadiging opgelopen tijdens schildklierchirurgie) en soms ook in het kader van een algemene neurologische aandoening (bv. amyotrofe lateraalsclerose of ALS).
De etiologie van verworven stenoses t.h.v. de trachea is meer divers en wordt in volgorde van afnemende prevalentie voorgesteld in het onderstaande overzicht.
Overzicht 1: Etiologie
Structureel
- Iatrogeen (>50%)
- PITS (fibrineus of concentrisch)
- PTTS
- Idiopathisch (20%)
- Systeemziekten (20%)
- Relapsing polychrondritis
- GPA Granulomatosis with polyangiitis
- Amyloidose
- Andere granulomateuze aandoeningen: sarcoïdose & IBD, systeemlupus, reumatoïde artritis, epidermolysis bullosa
- Overige (<10%)
- Postinfectieus (bacteriële tracheïtis, tbc, papillomatose)
- Niet-iatrogeen trauma
- Inhalatie: chemisch/caustisch, brandwonden
- Extrinsieke compressie (goiter)
- Tracheobronchopathia osteochondroplastica
Dynamische luchtwegcollaps
- Excessive dynamic airway collapse (EDAC)
- Tracheobronchomalacie (TBM)
Enerzijds zijn er aandoeningen die leiden tot een structurele verandering van de subglottis en trachea. Anderzijds kunnen er ook dynamische veranderingen optreden die leiden tot klinisch relevante flow limitatie maar waarbij de anatomie behouden blijft. Structurele en dynamische problemen kunnen ook gecombineerd voorkomen bij dezelfde patiënt.
Veruit de meest prevalente vormen van verworven tracheastenose zijn de post-intubatie stenose (PITS) en de post-tracheotomie stenose (PTTS), die als iatrogeen worden beschouwd. Van PITS worden 2 vormen onderscheiden. Enerzijds het ontwikkelen van een fibrineus pseudomembraan op niveau van de cuff van de endotracheale tube dat kan fungeren als een klep en meteen na extubatie leidt tot dyspnee en/of stridor. Anderzijds het optreden van een complexe, circulaire stenose met een wisselende graad van (sub)mucosale inflammatie, waardoor deze vorm van stenose zich verder kan ontwikkelen en enige tijd na extubatie tot symptomen zal leiden. Belangrijk in de preventie van PITS is het afstemmen van de maat van endotracheale tube op de gestalte van de patiënt hetgeen klinisch meest relevant is in vrouwen met een kleinere gestalte. PITS is meestal eerder het gevolg van structurele schade aan de anterieure wand van de trachea, al dan niet met optreden van fractuur van 1 of meerdere trachearingen en presenteert zich in een driehoekige vorm met afname van de cross-sectionele oppervlakte van de luchtweg.
Idiopathische subglottisstenose (iSGS) is de tweede meest prevalente vorm van verworven tracheastenose en behelst per definitie de subglottis al dan niet gecombineerd met de proximale trachea. iSGS is een specifieke klinische entiteit die hoofdzakelijk voorkomt bij Kaukasische vrouwen van middelbare leeftijd die geen voorgeschiedenis rapporteren van een laryngotracheaal probleem, radiotherapie, schildklieroperatie, cervicale ingrepen, caustische/thermische schade en geen endotracheale intubatie of tracheotomie ondergingen binnen een 2 jaar tijdsinterval voorafgaand aan de eerste klinische symptomen. Onderliggend systeemlijden dient tevens formeel uitgesloten te worden.
Tracheastenose kan tevens een klinische presentatie zijn van een systeemziekte meest frequent in kader van vasculitis type granulomatosis met polyangiitis (GPA) en relapsing polychrondritis (RP). RP is een zeldzame auto-immune aandoening die leidt tot inflammatie en destructie van kraakbeen op verschillende niveaus: vooral oren, neus en gewrichten maar ook tracheobronchiaal. RP presenteert zich vaak als een symmetrische subglottisstenose maar met progressie van de aandoening kan er ook flowrestrictie optreden op niveau van de distale trachea en de bronchi. CT scan toont een typische verdikking van de luchtwegwand met sparen van de posterieure zijde in vroegere stadia en vernauwingen die multifocaal kunnen zijn. Bij patiënten met RP kan ook tracheobronchomalacie (TBM) met luchtwegcollaps aanwezig zijn als gevolg van een structurele instabiliteit van de kraakbeenstructuren in de luchtwegwand.
Excessive dynamic airway collapse (EDAC) wordt gedefinieerd als een afname van meer dan 50% in de cross-sectionele oppervlakte van de luchtweg tijdens uitademen en is het gevolg van een uitgesproken uitstulpen van de pars membranacea tracheae binnen het trachealumen en dit met een intacte anatomie van de kraakbenige luchtwegwand. Essentieel in de klinische aanpak van EDAC is om een inschatting te maken van de mate van flow limitatie die hierbij geassocieerd is. Dynamische collaps van de posterieure tracheawand kan immers in zekere mate ook optreden als normaal fysiologisch fenomeen bij expiratie en kan meer uitgesproken zijn bij hoesten of geforceerde expiratie of zelfs vaak gezien worden in geval van astma, COPD, obesitas of hoge leeftijd.
In de diagnose en oppuntstelling van een laryngotracheale stenose staan multi-detector CT scan en laryngo/broncho-scopie centraal (Fig. 2.2.1). CT scan met multiplanaire reconstructie is onontbeerlijk om de locatie, uitgebreidheid, ernst en morfologie van de stenose te beoordelen. Gecombineerde inspiratie en expiratie opnamen geven een inschatting van de dynamische component en graad van luchtwegcollaps. Endoscopische evaluatie is echter nog steeds de standaard voor diagnose van laryngotracheale afwijkingen, laat tevens toe om de complexiteit en dynamiek van de luchtweg te kwantificeren en bepaalt rechtstreeks het behandelingsplan.
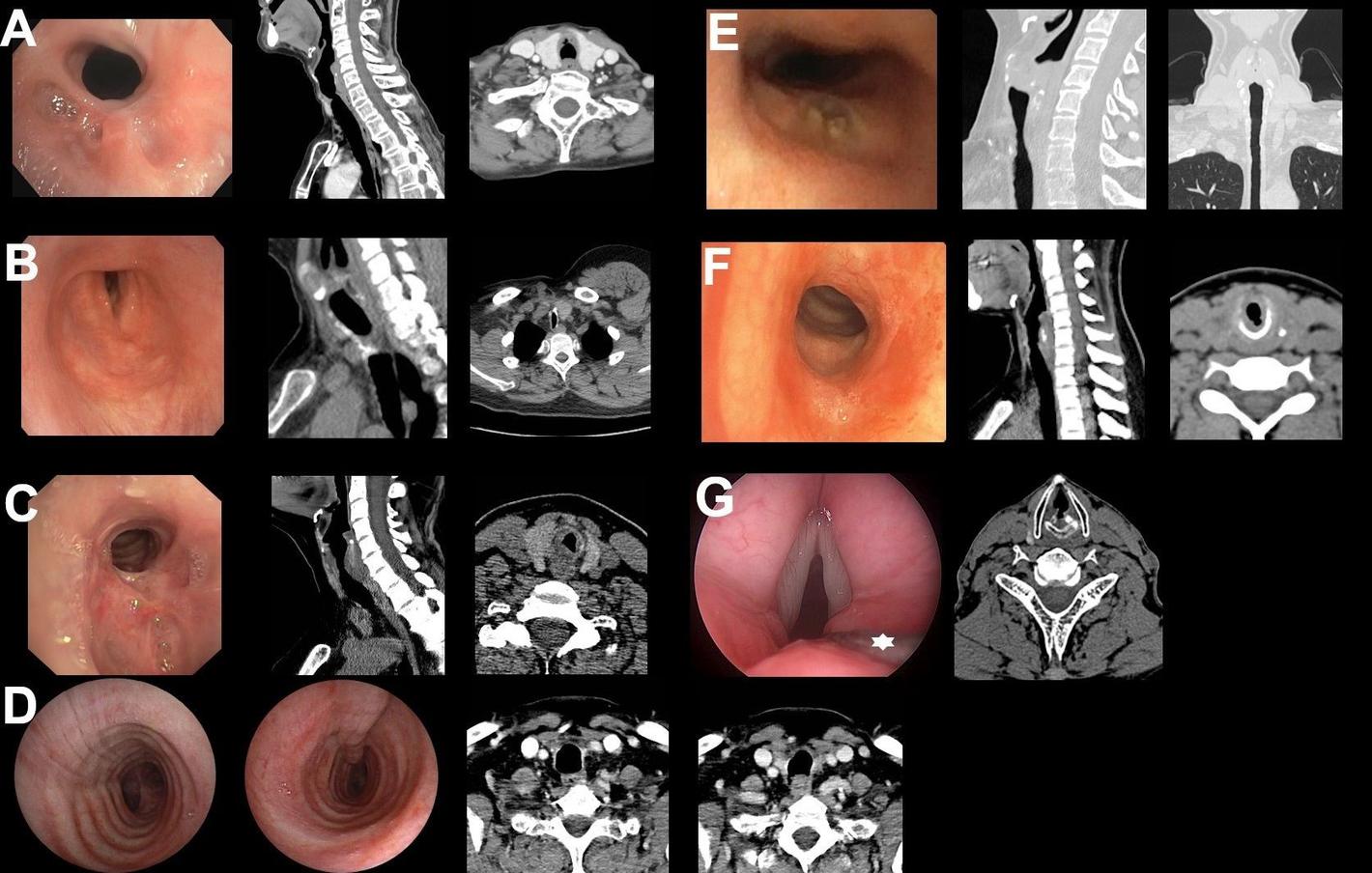
Figuur 2.2.1. Radiologische en endoscopische presentatie van tracheastenose
A: Post-intubatie stenose (PITS)
B: Post-tracheotomie stenose (PTTS)
C: Idiopathische subglottisstenose (iSGS)
D: Excessive dynamic airway collapse (EDAC) beelden in inspiratie (links) & expiratie (rechts)
E: Relapsing polychondritis
F: Granulomatosis with polyangiitis (GPA)
G: Posterieure glottisstenose
De fysiologische flow limitatie en functionele beperking van de patiënt kunnen ingeschat worden met een goed uitgevoerde spirometrie. De flow/volume curves toont een patroon van een gefixeerde hoge luchtwegobstructie en laat toe om het verschil te maken met een diagnose van astma of COPD bijvoorbeeld in jongere patiënten met al dan niet weinig specifieke symptomen (Fig. 2.2.2).
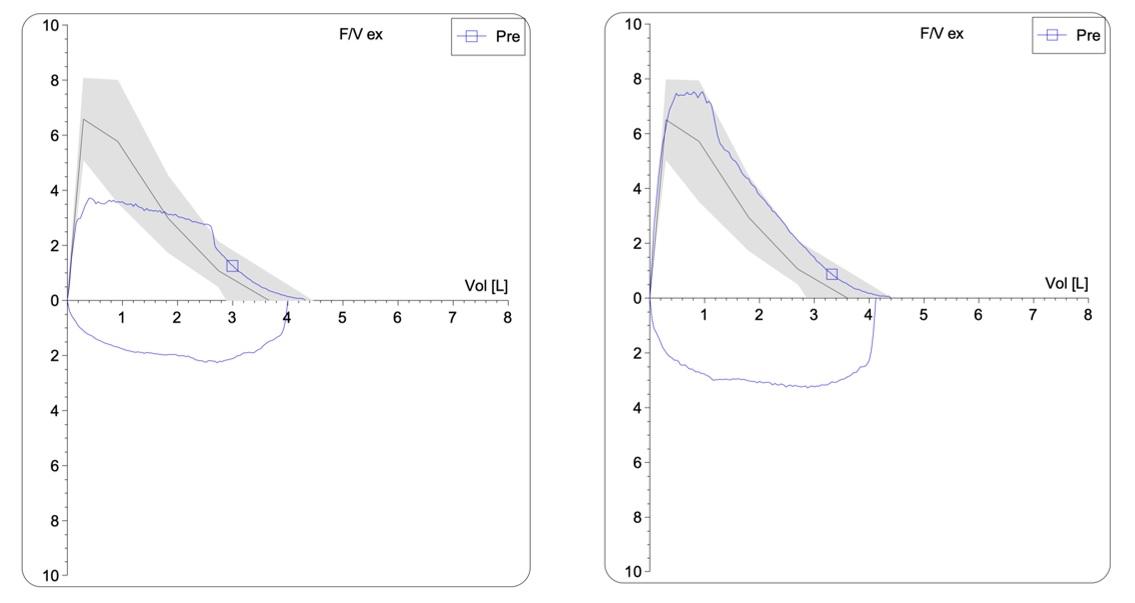
Figuur 2.2.2. Idiopathische subglottis stenose
Flow/volume curve voor (links) en na (rechts) endoscopische behandeling.
De peak inspiratory flow rate (PIFR) is de meest sensitieve spirometrische parameter van een hoge luchtwegobstructie en laat toe om de noodzaak aan interventie in te schatten (lower limit of normal 2.1 L/s). Ook peak flow meting (PEF, lower limit of normal 2.5 L/s) en de expiratory disproportion index (EDI; verhouding van FEV1 en PEF, lower limit of normal 0.75) laten toe om een tracheastenose kwantitatief te onderscheiden van obstructief bronchiaal lijden. Uiteraard kan de evolutie na behandeling eveneens opgevolgd worden door gebruik te maken van deze parameters.
De uitgebreidheid en ernst van de stenose en de impact op de functionaliteit bepalen de aanpak en behandeling. Ook etiologie, morfologie, stemkarakteristiek en co-morbiditeiten (obesitas, diabetes, cardiovasculair, steroiedgebruik, COPD, systeemziekte) bepalen therapiekeuze en prognose. Binnen het multidisciplinair overleg wordt een systeem voor classificatie gehanteerd dat locatie, lengte, en relatie tot de stembanden beschrijft en standaardiseert. Dergelijke classificaties zijn gerelateerd aan behandelingsopties en prognose. Een combinatie van beschrijvende aspecten en de Cotton-Myer classificatie wordt voorgesteld in Overzicht 2.
Overzicht 2: Classificatie
- Beschrijving:
- Type stenose
- Gefixeerd structureel
- Dynamisch (EDAC, tracheomalacie)
- Combinatie
- Structuur
- Circulair (web of complex litteken)
- Triangulair / Saber-sheath
- Excentrisch
- Floppy
- Extrinsieke compressie
- Transitie
- Abrupt
- Progressief toelopend
- Type stenose
- Lokalisatie: afstand tot stemspleet, cricoidkraakbeen en hoofdcarina
- Cotton-Myer:
- geïsoleerde stenose van <50% : geen fysiologische flowrestrictie
- stenose 50-70% : fysiologische flow restrictie bij inspanning
- stenose >70% : symptomen in rust
Referenties:
Gelbard A, Francis D, Sandulache V, et al. Causes and consequences of adult laryngotracheal stenosis. Laryngoscope. 2015;125(5):1137-43.
Aravena C, Almeida F, Mukhopadhyay S, et al. Idiopathic subglottic stenosis: a review. J Thorac Dis. 2020;12(3):1100-1111.
Tie K, Buckmire R, Shah R. The Role of Spirometry and Dyspnea Index in the Management of Subglottic Stenosis. Laryngoscope. 2020;130(12):2760-2766.
Bogdasarian R, Olson N. Posterior glottic laryngeal stenosis. Otolaryngol Head Neck Surg. 1980;88(6):765–772.